Oferta de servicios de TCR
- Equipo dedicado de científicos con más de 20 años de experiencia y pericia en la realización de cribaje mediante TCR
- Experiencia y pericia en el desarrollo de protocolos para nuevas clases de anticuerpos que incluyen: cócteles de anticuerpos murinos, humanizados, quiméricos y completamente humanos, fragmentos Fab/VH, proteínas de fusión, superantígenos biespecíficos, biómeros, tetrámeros y nanocuerpos, así como regiones variables unidas a la columna vertebral de varios portadores
- Servicios personalizados de etiquetado de anticuerpos/proteínas disponibles
- Científicos dedicados y experimentados para desarrollar y optimizar protocolos de tinción IHC a fin de generar datos de reactividad cruzada sólidos y significativos
- Directores de estudios experimentados con amplios conocimientos de histología e IHC para asesorar y guiar
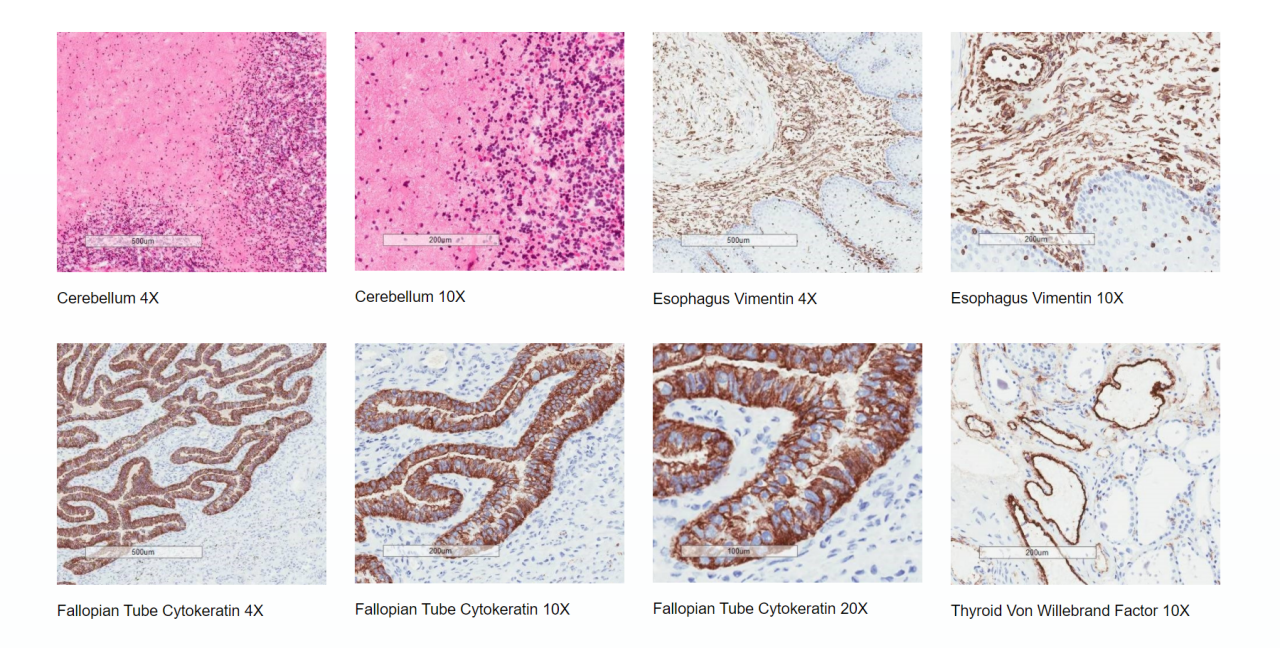
Centros autorizados con acceso a tejidos humanos y animales congelados de alta calidad que cumplen con las pautas reglamentarias de la FDA y EMA - Evaluación de la adecuación del tejido para cada estudio a fin de garantizar la integridad del tejido y antigénica (ver imágenes a continuación)
- Plataformas de tinción IHC manuales y automatizadas disponibles, lo que permite flexibilidad y personalización de los métodos de IHC
- Patólogos expertos (MRCPath, FRCPath, certificados por la junta) con experiencia en la evaluación e interpretación de tinciones de evaluaciones TCR
- Criterios de generación de informes flexibles para garantizar que se cumplan los objetivos del estudio